科学家成功将易转移的癌细胞变成脂肪细胞
脂肪细胞这东西,除了那些帮助伤口愈合的小肥肉,恐怕没几个人喜欢。它在我们体内,除了储存脂肪,让我们看起来更“丰满”之外,还会造成慢性炎症,增加糖尿病等多种疾病的风险。
不过,如果这些脂肪细胞是从更不受欢迎的细胞转化来的呢?比如癌细胞?
近日,巴塞尔大学的Dana Ronen和Gerhard Christofori等,使用降糖药罗格列酮联合MEK抑制剂曲米替尼,让乳腺癌细胞分化成脂肪细胞,降低了肿瘤的侵袭性,抑制了肿瘤转移。相关论文发表在Cancer Cell上[1]。
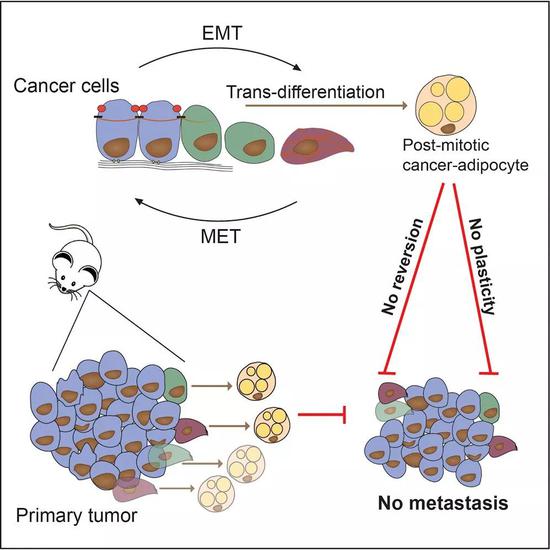
通过诱导间充质样的肿瘤细胞分化为脂肪细胞,阻止了肿瘤转移
上皮间充质转化(EMT)和反过来的间充质上皮转化(MET)可是肿瘤的一个绝招。本来上皮样的肿瘤细胞,转化成间充质细胞的模样,获得更强的运动能力,更容易转移到别的地方。而转移后,这些癌细胞又变回上皮细胞的形态,增殖能力更强,生长更快[2]。此外,肿瘤对化疗的耐药性也与EMT有关[3]。
肿瘤转移中EMT和MET的共同作用,可给人们出了个两难的问题。促进EMT吧,会增加肿瘤转移的风险,但要是抑制EMT,却有可能会促进转移瘤的生长,适得其反[4]。
转机发生在2010年。Venkata Battula等发现,上皮间充质转化出来的细胞,跟间充质干细胞一样,具有多谱系分化能力,比如分化成脂肪细胞。让间充质化的肿瘤细胞转化成别的组织不就破解了那个两难的问题了吗,Dana Ronen和Gerhard Christofori就此展开了研究。
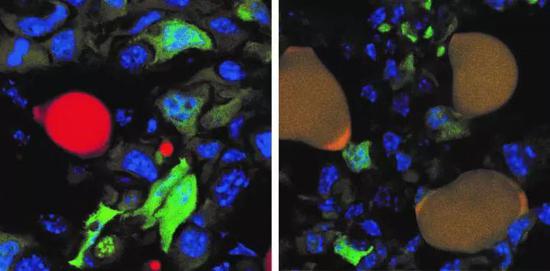
诱导前(左)肿瘤组织中的肿瘤细胞(绿)和脂肪细胞(红),以及诱导后(右)由肿瘤细胞分化成的脂肪细胞(红+绿形成暗黄色)
研究人员首先在体外进行了试验。经过查阅资料和多次试验,研究人员确定了罗格列酮+骨形成蛋白-2(BMP-2)的体外诱导方案。
罗格列酮+BMP-2的诱导,把EMT后的乳腺癌细胞转化成了脂肪细胞,表达各种脂肪细胞标志物,分泌脂肪细胞特异性因子脂联素,对异丙肾上腺素和胰岛素的反应也跟脂肪细胞一样。
失去了侵袭性和增殖能力
同时,分化成脂肪细胞后,这些间充质样癌细胞的细胞骨架发生了重组,诱导增殖的基因下调而抑制细胞周期的基因上调,。
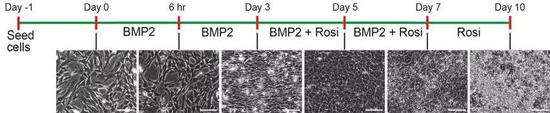
罗格列酮和BMP-2的诱导下,间充质样的肿瘤细胞逐渐转化为脂肪细胞
而且这样的分化是不可逆的。在诱导分化9天后,撤去诱导分化培养基,换上普通培养基,这些细胞也始终保持脂肪细胞的特征,而没有恢复成间充质样的癌细胞。
进一步的研究发现,在罗格列酮+BMP-2的组合中,罗格列酮直接诱导了癌细胞分化成脂肪细胞,而BMP-2则通过对细胞周期的调控促进这一过程,其作用可以用MEK抑制剂代替。
在肿瘤中,发生EMT的细胞主要存在于肿瘤浸润前沿,也是肿瘤转移的主力。诱导脂肪分化虽说不能影响哪些上皮形态的肿瘤细胞,但应该可以阻止肿瘤的转移。研究人员使用罗格列酮和FDA已经批准的一种MEK抑制剂曲米替尼,在小鼠乳腺癌模型中进行了试验。
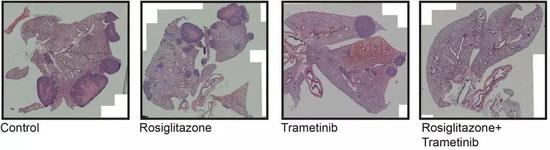
联合治疗的小鼠肺中,转移瘤更少
确实,在小鼠乳腺癌模型中单独使用曲米替尼就可明显抑制原发瘤生长,减小肿瘤质量。而联合使用罗格列酮并没有进一步抑制原发瘤生长,却大幅降低了肿瘤的侵袭性,减少了小鼠肺中转移灶的数量和大小。
“由于在患者中,这种方法只能与常规化疗联合进行测试,因此下一步将在乳腺癌小鼠模型中评估这种转分化疗法是否以及如何与常规化疗协同作用。”通讯作者Christofori表示,“此外,我们将测试该方法是否也适用于其他癌症类型。这些研究将在不久的将来继续在我们的实验室进行。”
相关阅读
-

印度版一加10T手机将获得新OxygenOS升级 安全补丁获得更新
一加已经开始向印度的一加 10T 设备推送最新的 OxygenOS 12 A 10 更新包。新 OTA 固件版本是 ...
2022-10-25 -

曝三星已向部分GalaxyS22手机推出OneUI5正式版系统更新
三星已经面向 Galaxy S22 发布了 One UI 5 0 的五个 Beta 测试版,并在 SDC 2022 主题演讲...
2022-10-25 -

WindowsPhone7已面世十二年 特殊排版UI等曾使其脱颖而出
2010 年 10 月 21 日,微软在全球推出了 Windows Phone 7 系统。于 11 月 8 日在美国地区...
2022-10-25 -
美光7450NVMeSSD将发布全新固件 服务质量可进一步提高
美光科技本周宣布为其 7450 NVMe SSD 推出符合开放计算项目数据中心 NVMe SSD 2 0 (OCP SSD ...
2022-10-25 -

小米12SUltra手机发送系统更新 流畅度等多个系统优化上线
小米 12S Ultra 开始推送 MIUI 13 v13 0 11 0 SLACNXM 稳定版更新,带来了多项系统优化。据...
2022-10-25 -

微软Win11 KB5020539更新上线 主要用途为测试服务管道
微软今日发布了 Windows 11 Insider Preview 10 0 25227 1010 (rs_prerelease) (KB5020539)版本。不过此次更新不包括任何新内容,旨
2022-10-26 -

高性价比爆款 28英寸4K显示器仅999元-天天短讯
联合创新28英寸显示器,型号为28D1U。这是一款4K显示器,采用IPS材质,色域覆盖99%sRGB和93DCI-P3,出厂...
2022-10-26 -

爱立信翱捷科技一同完成5G R17RedCap测试 结果达到预期
据 5G 推进组发布,2022 年 10 月,在 IMT-2020(5G)推进组的指导下,爱立信携手翱捷科技(ASR)顺利...
2022-10-26 -

三星5G网络设备确定被NTT East采用 全面展现企业多样化用例
三星宣布其 5G 网络设备被日本电信运营商 NTT East 采纳用于其 5G 专用网络。该日本电信运营商正...
2022-10-26 -

AirPodsPro使用更新固件后ANC系统反遭削弱 噪音隔离表现不佳
自 5 月的固件更新以来,用户反馈了一些苹果 AirPods Max 无线耳机主动降噪效果变差的报告,现在似...
2022-10-26 -

微软《帝国时代2:决定版》《帝国时代4》官宣:2023年登陆Xbox
北京时间10月26日凌晨,微软在《帝国时代》25周年发布会上宣布,《帝国时代2:决定版》将于2023年1月31...
2022-10-26 -

索尼发布新款高端电竞显示器:240Hz高刷 3999元-天天最资讯
10月26日消息,索尼INZONE27英寸240Hz疾速全高清高端电竞显示器M3正式上市并同步开启预售,首发价3999元...
2022-10-26 -

27寸4K游戏屏 泰坦军团2499元
现在4K的显示器正式开卷了。泰坦军团27英寸4K144HzIPS广色域HDR400双HDMI2 1Type-C65W旋转升降1ms电竞...
2022-10-26 -

微软新款Surface Pro 9国行首发:售价7788元起-信息
10月26日消息,微软新一代SurfacePro9二合一轻薄本国行首发开卖,售价7788元起,其升级12代酷睿U系列低...
2022-10-26 -

明晚发布!小米迄今最薄的笔记本:单手即可“捏起”-环球热头条
10月25日,@小米笔记本官微发布消息,将于10月27日发布小米笔记本Air13,现在已在京东商城、小米商城、...
2022-10-26 -

Win11 22H2出新Bug:任务管理器GPU读数“离奇”飙升
自从Win11推送22H2更新后,各种Bug似乎就从来没有消停过,且和NVIDIA的显卡存在一定的不兼容性,也因此...
2022-10-26 -

ZOL科技早餐:首款Web3手机起售价2.38万,魅族回应跨界造车
10月26日晨,为您推送的科技消息1RedmiNote12Pro+首发三星2亿像素传感器RedmiNote12系列体验小金刚将于1...
2022-10-26 -

仅1599元!小米34英寸曲面带鱼屏史低价:比首发便宜900元-当前消息
10月26日消息,小米34英寸电竞显示器WQHD曲面带鱼屏双·11促销开始了,预售价1899元,付20元定金抵扣320...
2022-10-26 -

能当电视用!三星32寸4K显示器1699元:带智能OS-消息
10月26日消息,三星S32AM700PC32寸的4K显示器当前京东秒杀价1699元,属历史低价,价保双11,秒杀价一直...
2022-10-26 -

27寸4KHDR600 飞利浦只要3899元-焦点速讯
飞利浦总是喜欢这种全能型产品。这个显示器除了不是MiniLED,其它都很高的指标。飞利浦27英寸NanoIPS4K1...
2022-10-26 -

AMD Zen3不死!三款锐龙PRO 5000上线:诡异12核心12线程
Zen4来了编程客栈,Zen3依然可以在特定领域发挥余热。AMD官网今天低调上线了三款锐龙PRO5000系列处理器...
2022-10-26 -

这价格买爆 红米K50U 12+256G只要2700元-当前热议
现在如果是骁龙8+的平台,普遍不便宜,基本都要3000元以上,不过杀价还得看红米。RedmiK50至尊版骁龙8+...
2022-10-26 -

【手慢无】直降300元 戴尔灵越14Pro超薄笔记本秒杀中-世界时讯
要说11·11大促入手什么产品最划算,那就必须得是电子产品,就如同这款戴尔灵越14Pro超薄笔记本,狂欢大...
2022-10-26 -

已有两起!RTX 4090发生“自燃”烧毁 NVIDIA回应:已着手调查
第一批入手RTX4090本应该是件高兴事儿,但没成想,已经先后有至少两名用户出现玩游戏时显卡烧毁的情况,...
2022-10-25
精彩推荐
阅读排行
最新推送
- 浙江传媒学院将部分卫生间改为女生专用:男网友集体好评
- 谷歌因支付应用和应用内支付系统再被印度罚款93.6亿卢比
- Redmi Note 12配旗舰传感器IMX766 米粉:友商克星 除了Redmi还有谁
- 43岁"海王"杰森莫玛晒海边度假照 与友人钓鱼超开心-天天视讯
- 空气开关和漏电保护器的区别都有什么?空气开关和漏电保护器选择哪个好?
- moto Razr 2022折叠屏手机海外发售:比国内贵2000元
- 原版发布23年后:《帝国时代2:决定版》终于登陆Xbox平台
- 空气开关符号解析 空气开关符号的含义分别是什么?
- 空气开关的选择注意事项都有什么?空气开关种类及接线注意事项详细介绍
- 空调稳压器有效果吗?空调稳压器应该怎么使用?
- 空调稳压器有什么作用?空调稳压器怎么选?
- 可见光无线通信的技术难点都有什么?可见光无线通信的发展方向是什么?
- 开关电源的安装方法都有什么?开关电源设计入门详细介绍
- 开关电源类型分类都有什么?开关电源选购指南详细介绍
- 开关电源工作原理介绍 开关电源使用注意事项都有什么?
- 开关电源的工作原理是什么?开关电源的组成结构介绍
- 绝对地址是什么?绝对地址和相对地址的区别是什么?
- 进程间通信和线程间通信的区别都有什么?进程间通信效率最高的是什么方式?
- 进程间通信的方式有哪几种?进程间通信的六种方式的优缺点有哪些?
- 接入网有哪些特点和作用?接入网与核心网的区别都有什么?
- 接入网特点有哪些?接入网建设的必要性和重要性有哪些?
- 接入网的拓扑结构都有什么?接入网的主要接口有哪些?
- 《守望》剧情模式或已泄露 过场动画截图疑似流出-天天聚看点
- 接入网的发展背景详细介绍 接入网的发展趋势都有什么?
- 接入网的定义是什么?接入网的特点都有什么?
- 索尼推荐你开启PS5游戏共享:买一份游戏 全家都能玩-今热点
- 并行计算是什么?并行计算与分布式计算的区别有哪些?
- 磁性元件有哪些?磁性元件主要有哪些作用?
- 存算一体技术是什么?存算一体技术的核心优势是什么?
- 存算一体芯片发展趋势介绍 存算一体芯片主要有什么用?
- 电梯变频器工作原理介绍 电梯变频器维修与保养注意事项介绍
- 动态码率是什么?动态码率和固定码率有什么区别?
- 高压变频器原理是什么?高压变频器日常维护保养注意事项都有什么?
- 乐卡空调出席2022年德国纽伦堡Chillventa国际暖通展
- 56岁“拳王”泰森被传去世 本人更新社交媒体辟谣-天天速读
- 一加Nord N300 5G手机发布:约1650元!
- 双11特惠!27英寸高清显示器抄底价499元-天天热推荐
- 百公里只需4个油 广汽传祺影豹混动上市:12.80万起
- Redmi Note 12 Pro+首发三星2亿像素传感器
- UX中的游戏化(四):用户旅程-环球今日讯
- 李佳琦双11预售首日卖出215亿?美腕否认:数据不实
- 中国无人配送市场高速增长 京美菜毫末场景连接能力提升
- 聚光为力,探索更远,探路者携手Jackery电小二引领绿色低碳户外生活
- 苹果正式允许iOS发行NFT 手续费30%
- 灵动岛赢麻了!iPhone14 Pro赚翻了
- 光孤子通信的原理介绍 光孤子通信的优势是什么?
- 《战神:诸神黄昏》宣发开启!美国已经有地铁换上奎爷广告-环球看点
- 光学成像的演进史:软性内镜的这十年与下个十年
- 王者荣耀7周年皮肤,鬼谷子五谷丰年外观亮相
- Redmi首款投影仪亮相:小身材看“大”场面
- 2022抖音生活服务服务商伙伴大会今日召开
- 《黑魂2原罪学者》PC服务器现已恢复 原版稍后上线-当前讯息
- 【手慢无】超值特惠!4K 27英寸显示器秒杀1499元-世界观热点
- 【手慢无】读速达3500MB/s!京东京造1TB固态仅需509元
- 《权力的游戏》演员麦茜·威廉姆斯回望参演十年:虽然结局有点烂尾但我以它为豪-今日快讯
- 《橡胶强盗》开启万圣节活动 新增主题武器、皮肤
- 当众“鞭尸”?有人用《哥谭骑士》IGN打分框做了个《漫威蜘蛛侠:重制版》的MOD
- AMD突然狂吹4个月的老卡RX 6700:性能差不多 但我省电
- 京东公开“库存数据调整方法”专利
- 魅族真要造车?官方回应:确实在储备汽车领域相关人才
- 英特尔CPU怎么看几代型号 酷睿怎么分代看是第几代的-环球热推荐
- 小米34英寸曲面带鱼屏史低价:仅1599元
- 小米笔记本Air 13官宣:小米史上最薄!后天发布-全球通讯
- 《战神:诸神黄昏》中奎爷将比前作更暴力无情 战斗画面超激烈-世界时快讯
- 打造朋友圈,自动驾驶公司如何走向产业化?-全球快资讯
- iPhone 14 Pro新丑照:灵动岛露馅了-世界快播
- 三星Galaxy Z Fold4详解:业界独家防水折叠屏,为何只有三星可以做到?
- 抢跑双11 海康存储发布PCIe 4.0旗舰固态硬盘C4000
- 徐梦桃X LG styler蒸汽衣物护理机,一起解锁品质新生活
- 北京微软Surface Go 3二合一黑色仅3499-热文
- 在深秋的大兴安岭也能随时随地保持在线 惠普战66五代移动办公体验-全球快讯
- 苹果tvOS 16.1正式版发布-环球即时看
- iPadOS 16.1新功能来了:安卓笑晕
- 微软在全新支持文档中确认Outlook新Bug 并承诺将很快修复
- 全面风险管理平台系列产品之内控合规管理系统
- 印度版一加10T手机将获得新OxygenOS升级 安全补丁获得更新
- 谷歌PlayStore应用新颜色更加有活力 电话等自带程序图标换新
- 曝三星已向部分GalaxyS22手机推出OneUI5正式版系统更新
- WindowsPhone7已面世十二年 特殊排版UI等曾使其脱颖而出
- 美光7450NVMeSSD将发布全新固件 服务质量可进一步提高
- 小米12SUltra手机发送系统更新 流畅度等多个系统优化上线
- win10正版升级怎么升级 免费升级正版win10系统教程
- 怎么用nt6安装win7系统 nt6 hdd installer硬盘安装win7系统教程
- 昂达即将上市Z790PLUS新主板 外观分为黑白两款配色 不惧盐雾
- 教你用dos命令删除win7系统文件的方法
- 竟然不知LOL双倍经验在哪里 lol双倍经验
- 飞利浦更新QD-OLED带鱼屏显示器产品 其所用面板为三星出品
- 10.27世界恋爱日?这是真的吗? 世界恋爱日
- win10系统下yy语音无法打开如何解决 win10系统下yy语音无法打开的解决方法
- 联想笔记本电脑如何将F1-F12调整为传统键盘模式
- 联想旭日410at2080怎么样 联想旭日410at2080性能评测
- 空调吹的风不凉是怎么回事?空调吹的风不凉具体原因及解决方法
- 扩频通信调制方式有哪些?扩频通信的主要特点有哪些?
- 怎么自己安装win7系统 自己安装win7系统步骤是什么
- 吉利博越L新车上市在即 全系共六款车型 预售价最高17.58万
- 红米Note 12 Pro+发布 搭载2亿像素HPX旗舰大底
- 360浏览器打不开怎么办 可能的原因来解决
- lcd液晶显示屏原理及结构设计 LCD液晶显示屏原理
- 电路板怎么制作 电路板制作介绍
- win8.1 iso镜像破解版下载地址
- 量子通信的信道都有什么?量子通信的发展方向是什么?
- 小米4c最好用的系统版本 小米4c和小米4哪个好
- App Store正式允许NFT产品上线,但仍需交30%手续费
- 苹果CEO视察奥斯汀新园区 并将其工程团队研发新品进行展示
- 怎么做启动光盘 可引导光盘制作方法
- wp8手机怎么连接电脑具体方法
- 苹果笔记本电脑双系统如何切换
- 《生化危机8:村庄》第一/第三人称视角对比:迪米特雷斯库夫人更令人难以忘怀-当前播报
- 雅佳抽油烟机怎么样 雅佳抽油烟机清洗方法
- 笔记本键盘失灵怎么办 各种系统全解
- 大品牌奶粉有哪些牌子 奶粉哪里的好
- 电脑中rar压缩文件的密码忘记了怎么办 如何破解RAR密码
- 厨余垃圾有什么垃圾 厨余垃圾有哪些物品
- 华擎LiveMixerZ790主板亮相海外市场 新品接口数量丰富兼容高
- 联想电脑怎么刷机 联想电脑刷机教程
- 盈通H61价格多少 盈通H61价格详细介绍
- 刀片式(HAHD)服务器
- 电脑没静音但是没声音怎么回事?电脑没声音的修复方法
- 三星上网本如何重装系统|三星上网本重装系统教程
- xp怎么升级到win7 xp升级win7教程
- Win11 22H2出新Bug:任务管理器NVIDIA GPU读数“离奇”飙升
- win7系统二级网页打不开怎么办 win7二级链接打不开的解决方法
- 蓝牙耳机怎么和手机电脑连接 蓝牙耳机连接手机和电脑方法
- windows xp系统下鼠标光标变粗怎么解决
- 漏电开关能代替空气开关吗?空气开关和漏电保护器的区别详细介绍
- 分区丢失数据怎么恢复 分区丢失数据恢复方法介绍
- 步步高最新款手机 vivo X9 全新拍照旗舰智能手机
- 重装系统怎么格式化C盘 重装系统前格式化C盘方法
- 曼卡顿AURA STUDIO 3音箱评测:高颜值与高音质成就经典作品-世界微速讯
- 电梯门机变频器维护保养时需要注意的几点
- 滤波器的工作原理是什么?滤波器的作用详细介绍
- 夏普复古发布4G翻盖手机新品 内存仅1+8GB 可连接蓝牙5.0
- 因索尼投资《原神》成功 微软正加大对中国游戏的投资
- PSP3000官方版本和破解版本的区别
- win8/win8.1系统怎么添加磁盘分区 win8新建硬盘分区的方法
- CAD如何使用快速引线命令?CAD使用快速引线命令方法
- 【手慢无】超值优惠!小米34英寸显示器7.9折入手
- iPad3怎么越狱 iPhone、iPad越狱
- 滤波器分类主要包括哪些?如何才能选择正确的滤波器?
- 联想笔记本怎么恢复系统 联想笔记本电脑系统还原方法
- win7系统获得管理员取得所有权的操作步骤
- win7怎么设置兼容性_win7设置兼容模式的方法
- 深度一键重装系统步骤|深度一键还原装系统教程
- 华硕上架新款PN53迷你主机 将配备2.5G网口以及众多接口
- 淘宝双十一喵果活动怎么玩 喵果总动员活动时间玩法攻略
- 南天打印机怎么样 南天打印机有点有哪些
- Win8.1专业版如何激活?激活win8.1专业版的方法 激活步骤
- 苹果iphone4s 6.1完美越狱详细教程
- 开始菜单在右边怎么办 开始菜单在右边还原方法
- 钣金行业MES系统数据模型的设计与实现-热门看点
- 德力西开关怎么样 德力西开关特点介绍
- 如何用一键ghost安装win7 一键ghost还原win7系统教程
- 买二手苹果手机要注意什么 二手iphone验机方法 二手iPhone的验机指南
- 淘宝免费试用成功几率有多大
- 小米平板5内测推送全新系统版本 并提示更新启动加载时间较长
- 怎么解决win7看不了在线视频问题 win7看不了在线视频两种解决方法
- 透明头像_qq透明头像 qq透明头像怎么设置
- 192.168.0.1手机如何修改wifi密码?
- 绿色于行 再聚进博——松下携低碳成果亮相第五届进博会
- 如何查看微信qq空间照片 查看微信qq空间照片方法
- windows7系统出现“您可能是盗版软件的受害者”的解决方法具体步骤如下-全球快消息
- 索尼爱立信k818c详细参数介绍
- windows7系统打开移动硬盘很慢的解决方法-天天快播
- 分流器怎么用 分流器主要功能
- 面向连接和无连接的区别都是什么 实时语音业务适合哪种连接方式?
- 如何手动ghost装系统 ghost手动安装系统详细教程-当前短讯
- win10易升是什么_win10系统如何关闭易升-世界热资讯
- win7系统怎么设置每天自动关机 win7创建定时关机计划的方法
- 告诉你有效的cad2011序列号和密钥大全-环球报资讯
- 教你解决Windows10电脑鼠标光标乱跑的问题
- 彻底清理c盘垃圾怎么操作 彻底清理c盘垃圾操作方法
- 配电屏是什么?配电屏的作用主要有哪些?
- 2022淘宝双十一猫猫怎么玩 双十一喵果入口新玩法介绍-实时
- 怎么查看高铁票剩余几张 剩余火车票查询
- 3D打印技术简介 3d打印技术原理分享 应用领域
- 华硕笔记本进bios按哪个键 华硕手提电脑怎么进bios设置
- WindowsXP系统音量控制打不开的解决方法-世界微头条
- ios16.1正式版续航怎么样 ios16.1续航能力耗电快吗-环球新动态
- 苹果电脑坏了去哪里修 如何拯救摔坏的MacBook
- 极化码技术是什么有什么用?极化码的原理和优缺点详细介绍
- air是什么意思?苹果air是什么意思?
- 两款旧款理想ONE已能接收OTA升级 预计一周内可全部推送完成
- win7激活码64位旗舰版 win7 64位旗舰版激活密钥 最新win7 64位旗舰版产品密钥-环球今日报
- 京东:2022年上半年超过25000个店铺的成交额同比增长超过100%
- Nreal双11特惠活动开启 下单即有机会享5折优惠
- SQL Server无法连接到服务器怎么办 用户xxx登陆失败" 是因为什么原因呢
- 魅族已经开始准备造车:正高薪招人最高40K
- 带投影功能的手机有哪些 品牌推荐
- win7ie临时文件夹在哪里 清空win7ie临时文件夹的图文步骤-环球视点
- 烟感探测器的特点及工作原理
- Win7启动菜单如何修改 Win7修改启动菜单的方法-世界短讯
- qq头像女生背影 qq头像女生背影之如何设置
- 洗碗机品牌排行榜 洗碗机哪个牌子好
- win10系统安装iTunes后无法打开如何解决-新动态
- 小米13系列屏幕参数曝光 号称黑边巨窄
- u盘坏了怎么修复 u盘坏了修复方法
- win7系统安装补丁失败怎么办 win7系统无法安装补丁的解决方法
- WinXP系统上怎么发布iis XP系统发布iis的具体方法
- 磁性元件是什么?磁性元件的分类和应用范围分别有哪些?
- 变频器是什么?变频器主要有什么作用?变频器的保护功能有哪些?
- 三相稳压器使用注意哪些?三相稳压器工作原理是什么?
- ghost xp2精简版下载 ghost xp2精简版下载地址
- 三端稳压器是什么东西?固定三端稳压器的应用及使用注意
- 三端稳压器工作原理详细介绍 三端稳压器正确使用方法介绍
- 英伟达韩国CEO出面解释为何取消RTX4080 12GB显卡发布
- 如何正确安装电源滤波器?电源滤波器安装注意事项详细介绍
- 断路器选型原则及选购 如何选择合适的断路器?
- 嫦娥五号月壤样品最新研究成果发表:初始岩浆成分被成功复原
- 熔断器用断路器代替安全吗?熔断器和断路器的区别是什么?
- 恋爱脑是精神疾病?郭婉莹告诉你:有些苦她们不必吃
- Nothingear(1)迭代新品图曝光 外观升级幅度不大Logo稍变
- 老烟斗鬼故事第一季 老烟斗鬼故事-世界视点
- 爆料称华擎正在开发新款联名主题Z790主板 外观为银黑撞色
- OMG|看赵露思晒肉桂卷,原来甜妹人均面包脑袋
- EVGA旗下超频工具升级支持RTX4090显卡 可调节功率限制等
- 2006年长江文艺出版社出版的牛的书-环球通讯
- 周冬雨:梦幻与真实|嘉人封面
- 大众方向盘将换回实体按键:用户不满 误触很难受-世界今头条
- 双十一付了定金怎么退 2022双11定金可以退款吗-每日信息
- 牛津wolfson学院 英国牛津切沃尔学院
- 九号UiFi Pro,年轻人的第一款上牌“滑板车”-世界新要闻
- 杜伽发布白光版无线三模热插拔机械键盘 实现双系统自动识别功能
- Xbox国行极光银手柄开售!单手柄秒没 仅剩捆绑包-每日资讯
- 男子骑共享单车带俩妹子 警察叔叔请狠罚的动态图
- JOC发布全球运输供应商50强榜单 顺丰等8家中国企业上榜
- 两亩地等于多少公顷 两亩地等于多少简介介绍
- 去哪儿:国际航班量增加1倍 票价环比降二成
- 男主和女主是主仆动漫 女的是主人男的是仆人的动漫简介介绍
- 【手慢无】超薄机身全面屏荣耀平板X8抢购价1349元-实时焦点
- 没有人能够永远年轻,但希望她是
- Nreal Air升级适配PS和Xbox 游戏设备全面适配
- 暗影精灵8Pro锐龙版预售到手价7499元-当前动态
- 【手慢无】支持7700毫安电池的联想小新Pad入手仅需1849元-热推荐
- 全新Zytel 可再生牌号助力打造 强度更高、重量更轻的折叠屏手机
- 【手慢无】小米平板5限时秒杀福利到手只要1499元-环球速讯
- 12306推出积分可兑午餐功能 支持旅客兑换订餐积分
- 我在不丹安缦11年,这里不富裕,却是最幸福的地方
- 小米旗下最薄笔记本亮相:小米Air 13仅12mm厚度-当前速讯
- iPad OS16正式版系统发布:台前调度功能正式支持-全球热消息
- 网传极氪001专利图显示新车将配置车顶激光雷达 表现更加全能
- 小米34英寸曲面显示器到手价1599元 全局低蓝光-每日速讯
- 【手慢无】联想ThinkPad T14新品商务本特卖:7499元抢!-天天动态
- 自动驾驶汽车变革卡在慢车道?
- “大头君有点困”原来网络摄像头还可以这样
- Steam新定价工具上线 将建立更规整的价格审核频率
- AMD全新移动GPU遭爆料 并称RX-7900M将与RTX4090竞争
- 【手慢无】惠普暗影精灵8笔记本7699元 12代I7-12700F处理器-环球热文
- 苹果上调音乐和视频等服务订阅价 版权太贵迫不得已
- 2022拼多多双十一有什么活动吗 拼多多双十一满减规则
- 官宣降价3.7万用户维权:"特斯拉无耻"





























